Wie wirken neue Medikamente beim Menschen?
Klinische Studien geben Antworten
Nur wenn ein Wirkstoff alle vorklinischen Prüfungen bestanden hat, darf er zur Untersuchung am Menschen eingesetzt werden. Diese wird in Rahmen von klinischen Studien durchgeführt. Eine klinische Studie muss nicht notwendigerweise in einer Klinik durchgeführt werden. Neben den Kliniken können auch ganz normale Arztpraxen an Studien mitarbeiten, also ein sog. Studienzentrum sein.
Die klinische Untersuchung eines neuen Wirkstoffs ist in mehrere Phasen unterteilt.
Entwicklungsphasen im Überblick
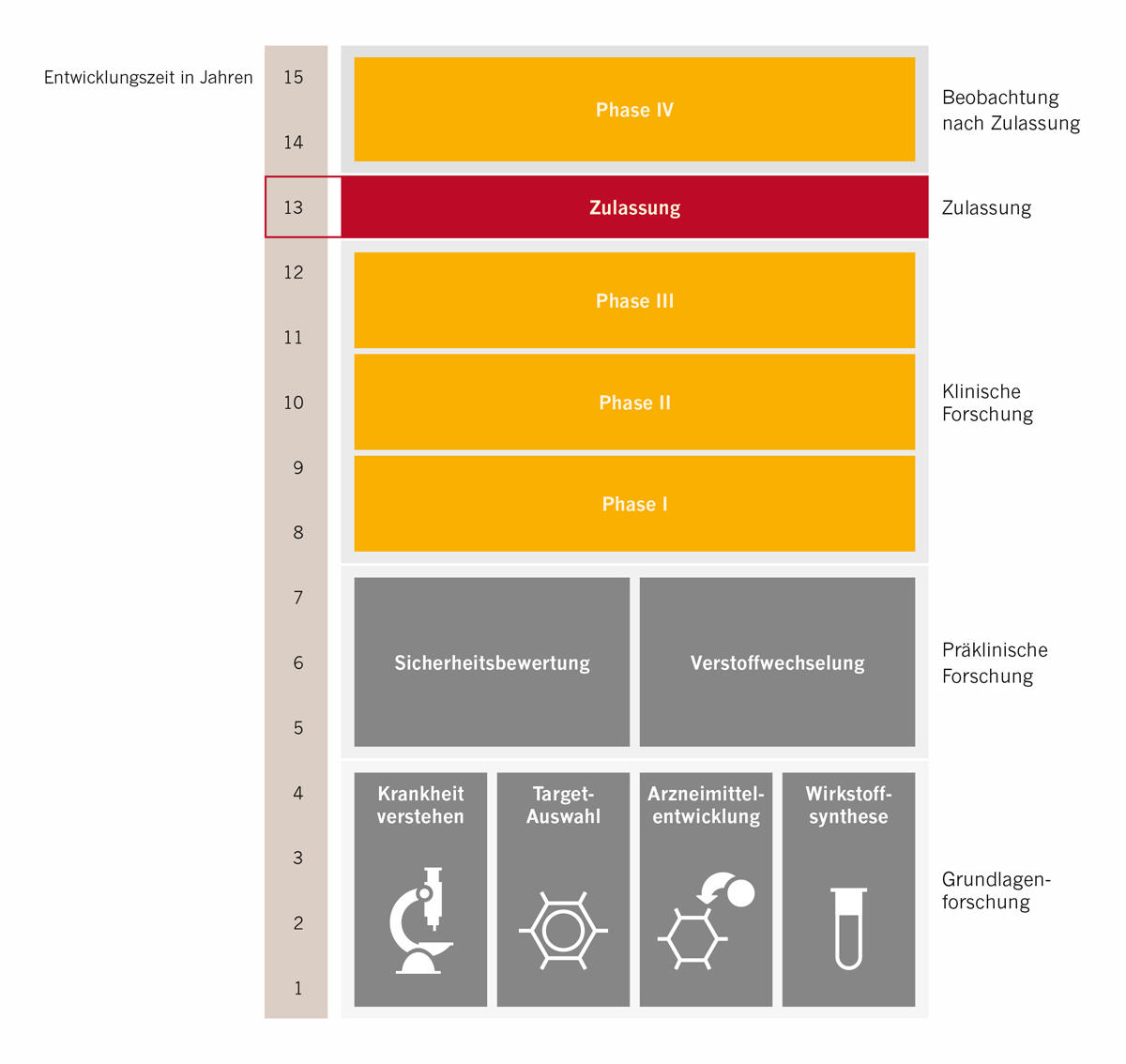
Phase I
In dieser frühesten Phase der klinischen Erprobung wird das Medikament an gesunden Menschen untersucht. Man kann in diesen Untersuchungen noch nicht feststellen, ob das Medikament einen positiven Einfluss auf die Krankheit ausübt, da die Teilnehmenden ja nicht erkrankt sind. Man möchte vielmehr herausfinden, wie der Wirkstoff durch den Körper wandert, wie er sich darin verteilt und wie lange es dauert, bis er wieder ausgeschieden wird. Außerdem möchte man erfahren, wie gut das neue Medikament vertragen wird und welche Nebenwirkungen es möglicherweise verursacht.
Phase II
Ist die Phase I positiv verlaufen, wird das Medikament im zweiten Schritt an erkrankten Menschen untersucht. Erst in dieser Phase kann festgestellt werden, ob das Medikament die gewünschte Wirkung bei Patient*innen entfaltet. Phase-II-Studien werden mit einer kleinen Anzahl von Patient*innen durchgeführt.
Meist nehmen 100 bis 500 Patient*innen aus verschiedenen Ländern teil. Phase-II-Studien überprüfen neben der Wirksamkeit des Medikaments auch seine Verträglichkeit und die optimale Dosis. Es wird untersucht, bei welcher Dosis das Medikament am besten wirkt und gleichzeitig die geringsten Nebenwirkungen aufweist.
Phase III
Jetzt geht die Forschung an dem neuen Medikament in die Breite. An Phase-III-Studien nehmen weltweit meist mehrere Tausend Patient*innen teil. Mit ihrer Hilfe möchte man überprüfen, ob die Ergebnisse der Phase-II-Studie auch bei einer großen Anzahl von Patient*innen gültig sind. Vor allem möchte man in dieser Phase auch mehr über das Nebenwirkungsprofil des Medikaments erfahren. So möchte man z.B. herausfinden, ob es Reaktionen gibt, die nur bei bestimmten Bevölkerungsgruppen auftreten oder wie häufig bestimmte Reaktionen während einer Behandlung auftreten. Ist auch diese Phase der Untersuchung erfolgreich, wird im nächsten Schritt die Zulassung des Medikaments beantragt. Die Zulassung muss vom Hersteller bei den Behörden beantragt werden. Fällt der Zulassungsentscheid positiv aus, kann das Medikament in den Markt eingeführt und von Ärzt*innen verschrieben werden.
Eine Besonderheit der Phasen-II- und -III-Studien ist der vergleichende Ansatz. Bei einer Vergleichsstudie teilt man die Patient*innen in verschiedene Gruppen ein, welche unterschiedlich behandelt werden. Meist erhält eine Gruppe das neue Medikament (Prüfmedikament), während die andere Gruppe mit einem bereits zugelassenen Medikament (Standardtherapie) behandelt wird. Dabei handelt es sich oft um jenes Medikament, das Ärzt*innen bereits standardmäßig für die Behandlung der Krankheit einsetzen. Bei einer anderen Studienvariante erhalten die Teilnehmenden eine Kombinationstherapie. Eine Gruppe erhält dann eine Kombination aus Basistherapie und Prüfmedikament, während die andere Gruppe eine Kombination aus Basistherapie und einem Scheinmedikament (Placebo) erhält. Das Placebo sieht genauso aus wie das Prüfmedikament, enthält jedoch keinen Wirkstoff. Durch die Kombinationstherapie wird sichergestellt, dass alle Teilnehmenden einer Studie eine Behandlung für ihre Erkrankung erhalten, auch dann, wenn sie in der Placebogruppe behandelt werden.
Zulassung
Die wichtigsten Voraussetzungen zur Zulassung eines Medikaments sind eine angemessene Qualität bei der Herstellung, Wirksamkeit bei der Behandlung der untersuchten Krankheit und als wichtigstes Kriterium die Sicherheit.
Damit ein Meidkament als sicher bewertet werden kann, muss es ein günstiges Nutzen-Risiko-Verhältnis aufweisen. Das bedeutet, dass die gewünschte Wirkung des Medikaments mit möglichst wenigen und möglichst harmlosen Nebenwirkungen einhergehen muss.
Das Nutzen-Risiko-Verhältnis ist das strengste und wichtigste Zulassungskriterium, das die zuständigen Behörden bewerten. Selbst nach erteilter Zulassung wird das Nutzen-Risiko-Verhältnis laufend überprüft. Stellt sich z.B. nach der Zulassung heraus, dass bisher unbekannte Nebenwirkungen bei Patient*innen aufgetreten sind, so hat dies Auswirkungen auf die Zulassung. Dann kann es sein, dass das Medikament nur noch mit Einschränkungen verschrieben werden darf. Im schlimmsten Fall muss es sogar ganz vom Markt genommen werden.
Während des Zulassungsverfahrens wird auch ein sehr wichtiges Dokument erstellt: die „Zusammenfassung der Merkmale des Arzneimittels“. Aus ihm geht später unter anderem die Gebrauchsinformation (Beipackzettel) hervor. Der Beipackzettel enthält alle wichtigen Informationen für Patient*innen über die Anwendung, Gegenanzeigen, Dosierung, Wechselwirkungen und Nebenwirkungen des Medikaments. Die Gebrauchsinformation darf nur mit Genehmigung der Behörde geändert werden.

Forschung nach Zulassung
Dass es ein Medikament bis zur Zulassung schafft, ist in etwa so selten wie ein Sechsers im Lotto. Unter 10.000 möglichen Wirkstoffen kann am Ende nur ein einziger als Medikament zugelassen werden. Wenn nun ein Medikament diesen aufwendigen Prozess erfolgreich durchlaufen hat und von den zuständigen Behörden zugelassen wurde, warum geht die Forschung nach der Zulassung dann noch weiter?

- Die Auswahl von Studienteilnehmer*innen von Phase I – III Studien erfolgt nach strengen Kriterien. Teilnehmende müssen möglichst gleiche Voraussetzungen aufweisen, damit die Ergebnisse der Untersuchungen vergleichbar sind.
- Die Medikamentengabe während der Phase I – III Studien weicht oft von der Einnahme unter Alltagsbedingungen ab. Auch unterschiedliche Ernährungsgwohnheiten können einen großen Einfluss auf die Wirkung eines Medikaments haben.
- Begleiterkrankungen und andere Faktoren wie z.B. Wirkungen nach Langzeiteinnahme können in Phase I – III Studien nicht oder nur unzureichend erfasst werden.
Um diese Wissenslücken zu schließen, führt man neben anderen Maßnahmen auch Studien nach Zulassung durch. Diese sogenannten Phase-IV-Studien dienen einerseits dazu, bei einer großen Zahl unterschiedlicher Patient*innen Informationen zum Medikament zu sammeln. Anderseits können weitere Vergleiche mit bereits länger zugelassenen Medikamenten angestellt werden oder Kombinationstherapien von neuen Medikamenten mit herkömmlichen Medikamenten untersucht werden.