Wer ist an einer klinischen Studien beteiligt?
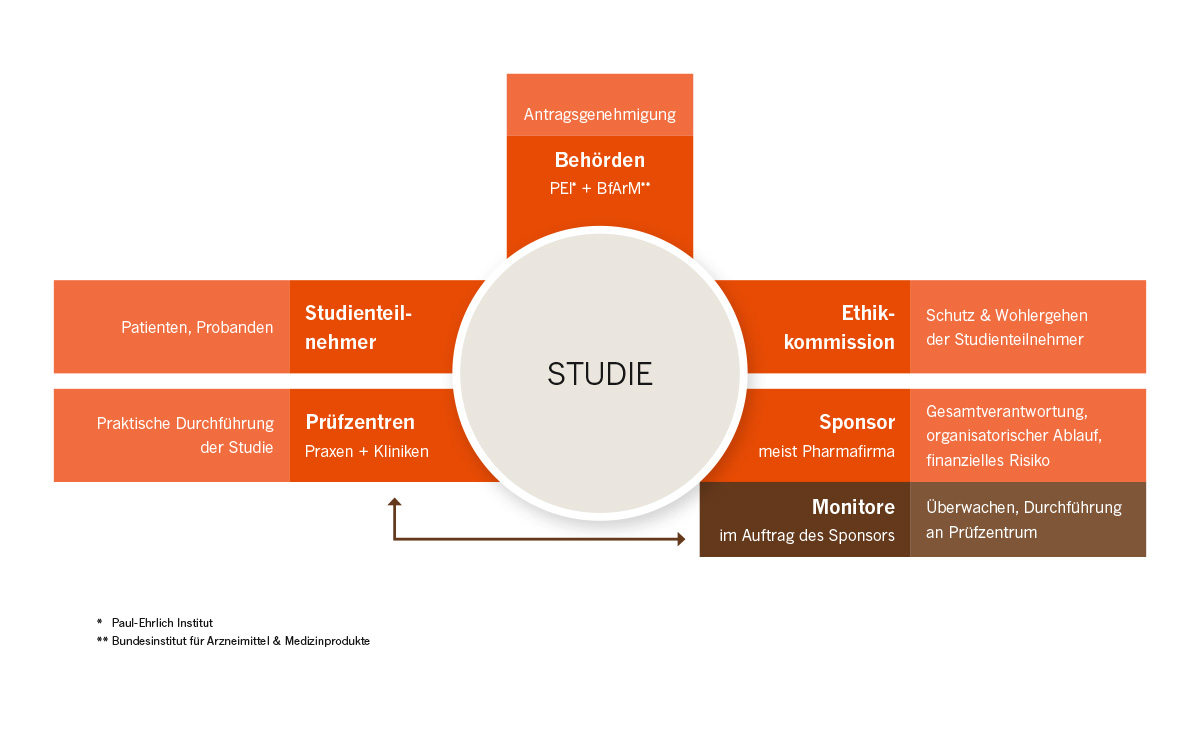
An einer Studie sind viele unterschiedliche Akteure beteiligt. Die meisten Studienteilnehmenden erleben bei ihren Besuchen am Studienzentrum lediglich das Studienpersonal. Doch bei einer Studie sind viele weitere Beteiligte im Hintergrund aktiv, um die Sicherheit der Studienteilnehmenden und die wissenschaftliche Qualität der Studiendaten zu gewährleisten. Die einzelnen Beteiligten haben unterschiedliche Aufgaben mit streng getrennten Verantwortungsbereichen:

- Auftraggeber (Sponsor): in der Regel eine Pharmafirma, ist Geldgeber*in der Studie, trägt die Gesamtverantwortung, sowohl für die Erstellung des Prüfplans und den organisatorischen Ablauf, als auch für die Sicherheit der Patient*innen. Finanziert außerdem die gesamte an dem neuen Medikament. ohne jedoch Einfluss auf das Studienergebnis nehmen zu können.
- Studienzentren: meist eine Klinik oder Arztpraxis. Sind allein verantwortlich für die Erhebung der Daten bei der Untersuchung der Studienteilnehmer*innen. Führen die Studien nach den Vorgaben des Prüfplans durch, sind dabei trotzdem unabhängig vom Auftraggeber der Studie.
- Monitor*innen: werden vom Sponsor entsendet um die wissenschaftliche Qualität der Daten an den Studienzentren zu überprüfen und sicherzustellen. Überprüfen die Einhaltung der Good Clinical Practice (GCP) (auf Deutsch: “Gute klinische Praxis”). GCP bezeichnet international anerkannte, nach ethischen und wissenschaftlichen Gesichtspunkten aufgestellte Regeln, für die Durchführung von klinischen Studien.
- Behörden: Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) oder Paul-Ehrlich-Institut (PEI). Prüfen die Studie gesamthaft auf alle inhaltlichen und medizinischen Aspekte. Nur wenn die Genehmigung der zuständigen Behörde vorliegt, wird die Studie zur weiteren Prüfung an die Ethikkommssion übergeben.
- Ethikkommission Aus verschiedenen Expert*innen zusammengesetztes Gremium welches alle Studien dahingehend überprüft, ob die Schutz und Wohlergehen der Studienteilnehmenden gewährleistet werden können. Ohne das positive Votum der Ethikkommission kann keine Studie durchgeführt werden.