Wie kommen neue Medikamente auf den Markt?
Das Wort Medikament stammt von dem lateinischen Wort „medicare”, das „heilen“ bedeutet. Bis ein neues Medikament auf den Markt kommt, vergehen durchschnittlich 12 Jahre. In klinischen Studien werden neue Medikamente in verschiedenen Stufen erprobt, um ihre Wirksamkeit, Sicherheit und Unbedenklichkeit für Patient*innen zu belegen. Wer an einer solchen klinischen Studie teilnimmt, erhält oft viele Jahre früher Zugang zu neuen Medikamenten als andere Patient*innen.
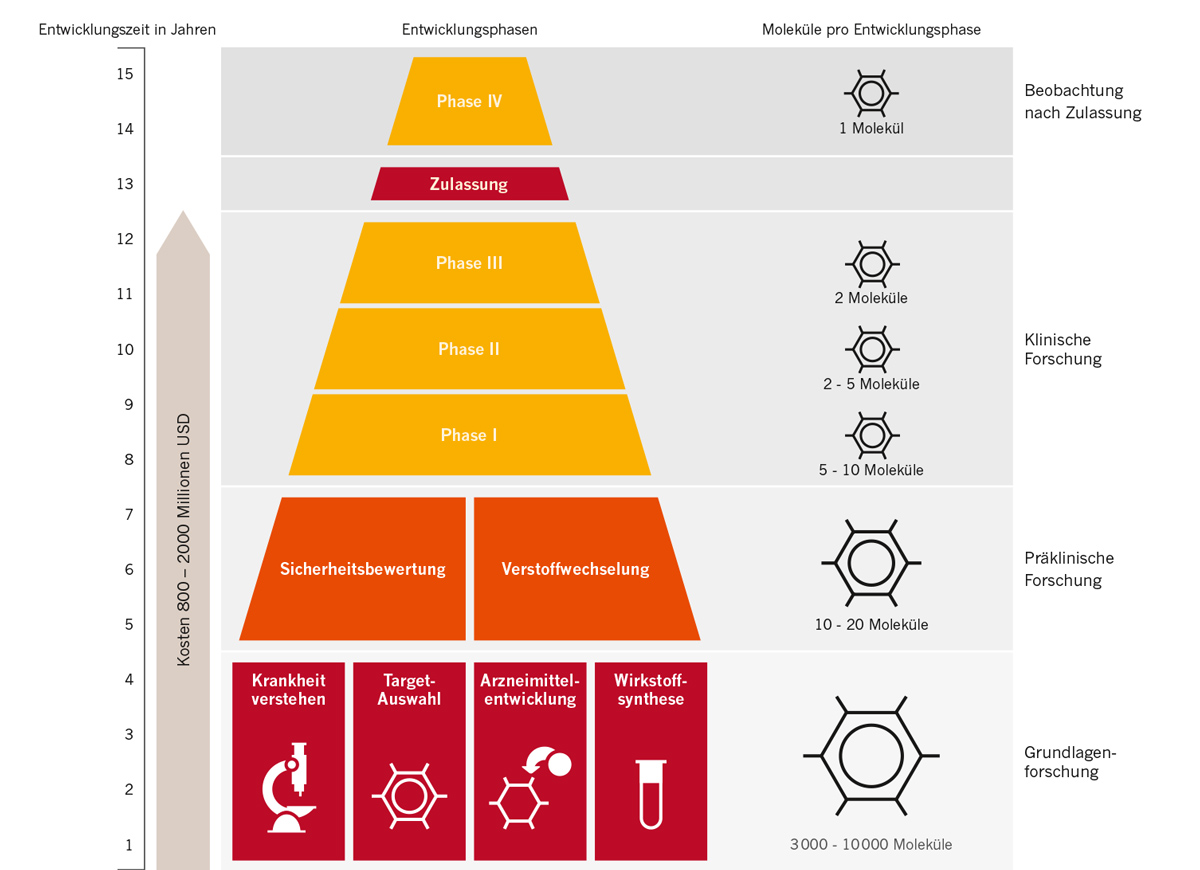
Die Erfolgsaussichten eines neuen Wirkstoffs tatsächlich alle Studienphasen zu bestehen und zum Medikament zu werden, sind gering. Aus 10.000 Wirkstoffen, die forschende Pharmafirmen wie Novartis ausfindig machen und untersuchen, schaffen es nur 5-10 Medikamentenkandidaten bis in die Phase der klinischen Studien. Von diesen wiederum bleibt am Ende oft nur einer übrig, der als Medikament zugelassen werden kann. Die Entwicklung von neuen Medikamenten ist also ein extrem aufwändiger Prozess mit sehr unsicherem Ausgang.
Entwicklungsphasen im Überblick
Bei der Entdeckung neuer Medikamente war man Jahrhunderte lang auf die Weitergabe tradierten Wissens oder zufällige Beobachtungen angewiesen. Noch immer spielt der Zufall bei der Entdeckung neuer Medikamente eine Rolle. Jedoch ermöglicht die technische Entwicklung der letzten Jahrzehnte Pharmaforscher*innen mittlerweile ein sehr zielgerichtetes Vorgehen. Bei der Auswahl des Therapiegebiets, zu dem geforscht werden soll, sind zwei Fragen von zentraler Bedeutung:
- Stellt die Krankheit ein bedeutendes ungelöstes medizinisches Problem dar?
- Besitzen wir ausreichende Kenntnisse über die Ursache der Erkrankung bzw. die ihr zu Grunde liegenden Mechanismen oder können wir uns diese verschaffen?
Wenn beide Fragen mit Ja beantwortet werden können, entwickelt Novartis ein Forschungsprogramm, um die Erkrankung besser zu verstehen und eine wirksame Therapie zu finden.
Am Anfang der Entwicklung eines Arzneimittels steht in der Regel die Suche nach einem therapeutischen Angriffspunkt, genannt „Target“ (aus dem Englischen = Ziel). Denn alle Medikamente setzen letztlich an Molekülen in unserem Körper an, um in das Krankheitsgeschehen einzugreifen. Daher wird bei der Betrachtung des Krankheitsbildes überlegt, welches Molekül (= Target) bei einer Krankheit eine entscheidende Rolle spielt. Die meisten bekannten Targets sind Rezeptoren, Enzyme oder andere Eiweiße (Proteine). Nachdem bestätigt ist, dass ein gefundener Angriffspunkt (Target) bei der Entwicklung einer Krankheit eine Rolle spielt, beginnt die Suche nach einem Wirkstoff. Dazu wird eine Vielzahl von Substanzen darauf getestet, ob sie am Target die gewünschte Wirkung ausüben. Das geschieht zumeist durch eine breit angelegte Untersuchung (Screening) mehrerer Millionen Moleküle. Wirkung entfaltende Substanzen werden „Treffer“ oder „Hits“ genannt. An diesen Treffern führen die Wissenschaftler*innen nun chemische Tests und Veränderungen (Modifikationen) durch, die beispielsweise die Bindung am Zielmolekül optimieren. In dieser ersten Phase arbeiten Wissenschaftler*innen und Ärzt*innen weltweit in fachgebietsübergreifenden Teams zusammen.
„Präklinisch“ bedeutet: Bevor ein Wirkstoff bei Menschen – in der Klinik – angewendet werden kann, muss er im Labor und in Untersuchungen mit Tieren eine ausreichende Wirkung zeigen. Auch darf der Wirkstoff nicht toxisch sein, seine Ungiftigkeit muss daher nachgewiesen werden. In der präklinischen Forschung wird außerdem untersucht, wie gut der Wirkstoff vom Körper aufgenommen wird, wie er sich in Blut und Organen verteilt und wie er ausgeschieden wird. Viele dieser Fragen können an Bakterien, Zell- und Gewebekulturen oder im Reagenzglas geklärt werden. Viele Substanzen scheiden bereits in dieser frühen Entwicklungsphase aus. Die vorklinischen Tests dauern in der Regel zwei Jahre.
Nur wenn ein Wirkstoff alle vorklinischen Prüfungen bestanden hat, darf er zur Untersuchung am Menschen eingesetzt werden. Diese wird im Rahmen von klinischen Studien durchgeführt.
Wenn die Entwicklung eines Medikaments weitgehend abgeschlossen ist, werden der Zulassungsbehörde alle Ergebnisse aus der klinischen Forschung vorgelegt. Sie prüft alle Daten und entscheidet über die Zulassung.
Auch wenn Tausende von Patient*innen in die Studien vor Zulassung eingeschlossen waren, sind die Erkenntnisse über das neue Medikament zum Zeitpunkt der Markteinführung begrenzt. Daher werden auch nach der Zulassung und Markteinführung weiter intensiv zusätzliche Informationen zu dem neuen Medikament gesammelt, z.B. im Rahmen von Phase IV-Studien oder von Nicht-interventionellen Studien (NIS).