Wie kommen neue Medikamente auf den Markt?
Bevor ein neues Medikament auf den Markt kommt und Patient*innen helfen kann, muss es viele Hürden überwinden. Eine der wichtigsten Stationen auf diesem Weg sind die sogenannten klinischen Studien. Die Entwicklung eines neuen Medikaments ist ein komplexer und langwieriger Prozess. Im Durchschnitt dauert es rund 12 Jahre, bis ein Wirkstoff von der Idee bis zur Zulassung gelangt. Dabei schafft es nur ein sehr geringer Bruchteil der erforschten Substanzen tatsächlich zu einem zugelassenen Medikament zu werden. Von etwa 10.000 Wirkstoffen, die forschende Pharmafirmen wie Novartis untersuchen, schaffen es nur 5-10 in die klinische Prüfung. Von diesen wiederum bleibt am Ende oft nur ein einziger übrig, der als Medikament zugelassen werden kann. In klinischen Studien werden neue Medikamente in verschiedenen Stufen (auch Phasen genannt) erprobt, um ihre Wirksamkeit, Sicherheit und Unbedenklichkeit für Patient*innen zu belegen.
Entwicklungsphasen im Überblick
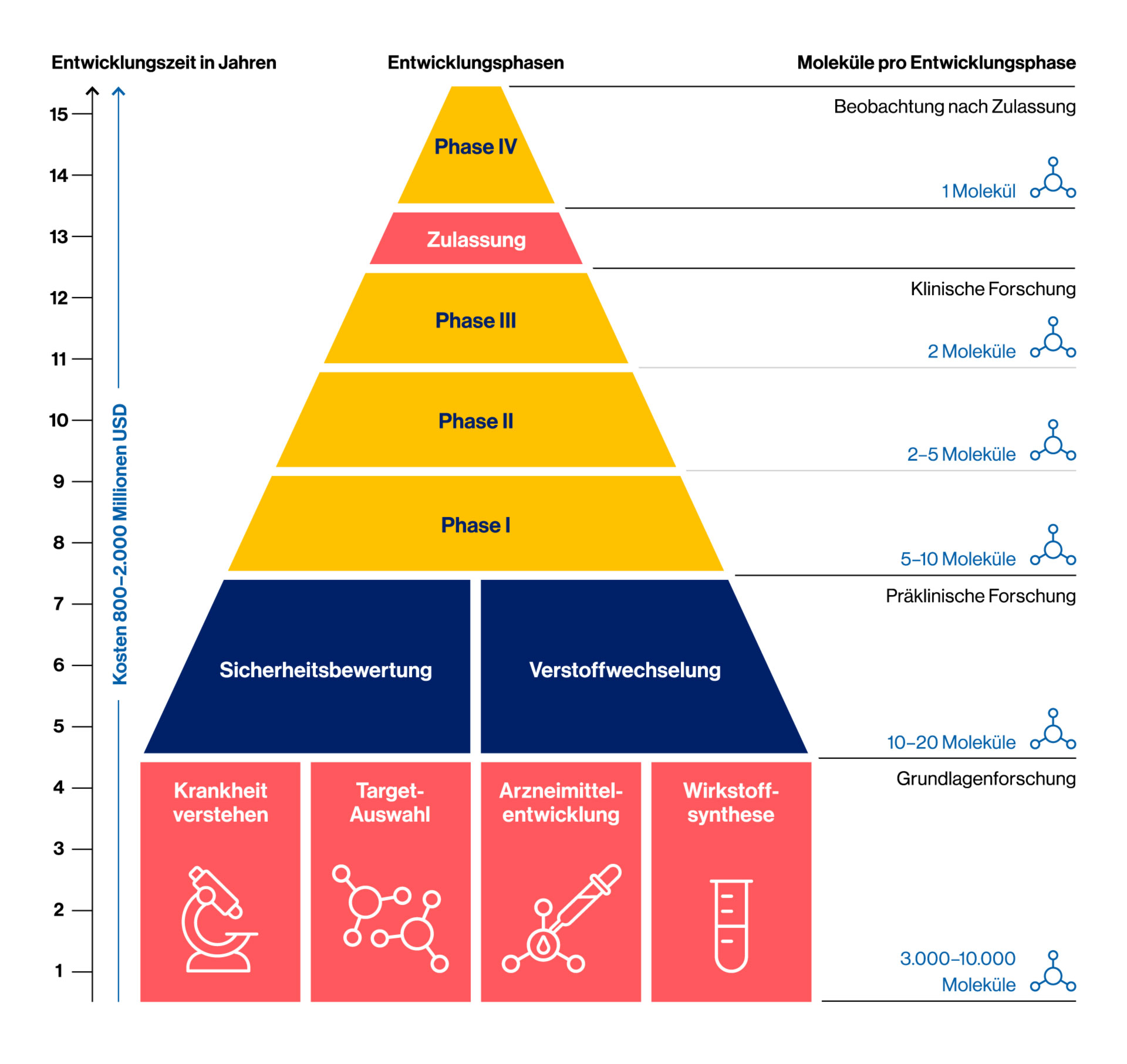
Bei der Entdeckung und Entwicklung neuer Medikamente war man Jahrhunderte lang auf die Weitergabe überlieferten Wissens oder zufälliger Beobachtungen angewiesen. Noch immer spielt der Zufall bei der Entdeckung neuer Medikamente eine Rolle. Allerdings ermöglicht die intensive Grundlagenforschung zu verschiedenen Erkrankungen und die technische Entwicklung der letzten Jahrzehnte Pharmaforscher*innen heutzutage ein sehr zielgerichtetes Vorgehen.
Am Anfang der Entwicklung eines Arzneimittels steht in der Regel die Suche nach einem therapeutischen Angriffspunkt („Target“, aus dem Englischen = Ziel). Also zum Beispiel ein Molekül, ein bestimmtes Merkmal oder eine Struktur im Körper, die bei einer Erkankung eine zentrale Rolle spielen. Häufig sind das Enzyme, Rezeptoren oder andere Proteine. Millionen Substanzen werden getestet, ob sie ganz gezielt auf dieses Target einwirken und dadurch Auswirkungen auf bestimmte Vorgänge haben können. Erfolgsversprechende Kandidaten (sogenannte „Treffer“ oder „Hits“) werden weiterentwickelt und optimiert. An diesen Treffern führen die Wissenschaftler*innen nun biologische und chemische Tests und Veränderungen (Modifikationen) durch, die beispielsweise die Bindung am Zielmolekül optimieren. In dieser ersten Phase arbeiten Wissenschaftler*innen und Ärzt*innen weltweit in fachgebietsübergreifenden Teams zusammen.
Bevor ein Wirkstoff am getestet werden darf, muss er sich im Labor und in Untersuchungen mit Bakterien, Zell- und Gewebekulturen sowie Tieren als wirksam und sicher erweisen. Dabei wird untersucht, wie der Wirkstoff aufgenommen, in Blut und Organen verteilt und ausgeschieden wird, ob er giftig ist und wie er auf Zellen und Gewebe wirkt. Viele Substanzen scheiden bereits in dieser frühen Entwicklungsphase aus. Diese präklinische Phase dauert meist rund zwei Jahre.
Nur Wirkstoffe, die alle präklinischen Tests bestehen, dürfen in klinischen Studien am Menschen geprüft werden. Diese Studien erfolgen in mehreren Phasen und untersuchen Sicherheit, Verträglichkeit, optimale Dosierung und Wirksamkeit im Vergleich zu bestehenden Therapien. Mehr Informationen zu Untersuchungen am Menschen finden Sie hier.
Bevor ein neues Medikament in der Apotheke erhältlich ist, muss es von den zuständigen Behörden zugelassen werden. In Europa ist das die Europäische Arzneimittel-Agentur (EMA) und zusätzlich in Deutschland das Bundesamt für Arzneimittel und Medizinprodukte (BfArM) oder das Paul-Ehrlich-Institut (PEI). Die Grundlage für eine mögliche Zulassung liefern die Daten und Ergebnisse aus klinischen Studien. Fachleute prüfen diese Daten sehr genau: Wie gut wirkt das Medikament? Welche Nebenwirkungen gibt es? Ist es besser als bisherige Behandlungen? Erst wenn alle Anforderungen erfüllt sind, darf das Medikament auf den Markt. Ein wichtiger Schritt, damit Patient*innen bestmöglich geschützt sind.
Auch nach der Markteinführung wird weiter geforscht, zum Beispiel in Phase-IV-Studien oder nicht-interventionellen Studien (NIS). Ziel ist es, noch mehr über die Anwendung, Langzeitwirkungen und die Sicherheit des Medikaments zu erfahren, da die Erkenntnisse über das neue Medikament zum Zeitpunkt der Markteinführung noch begrenzt sind.