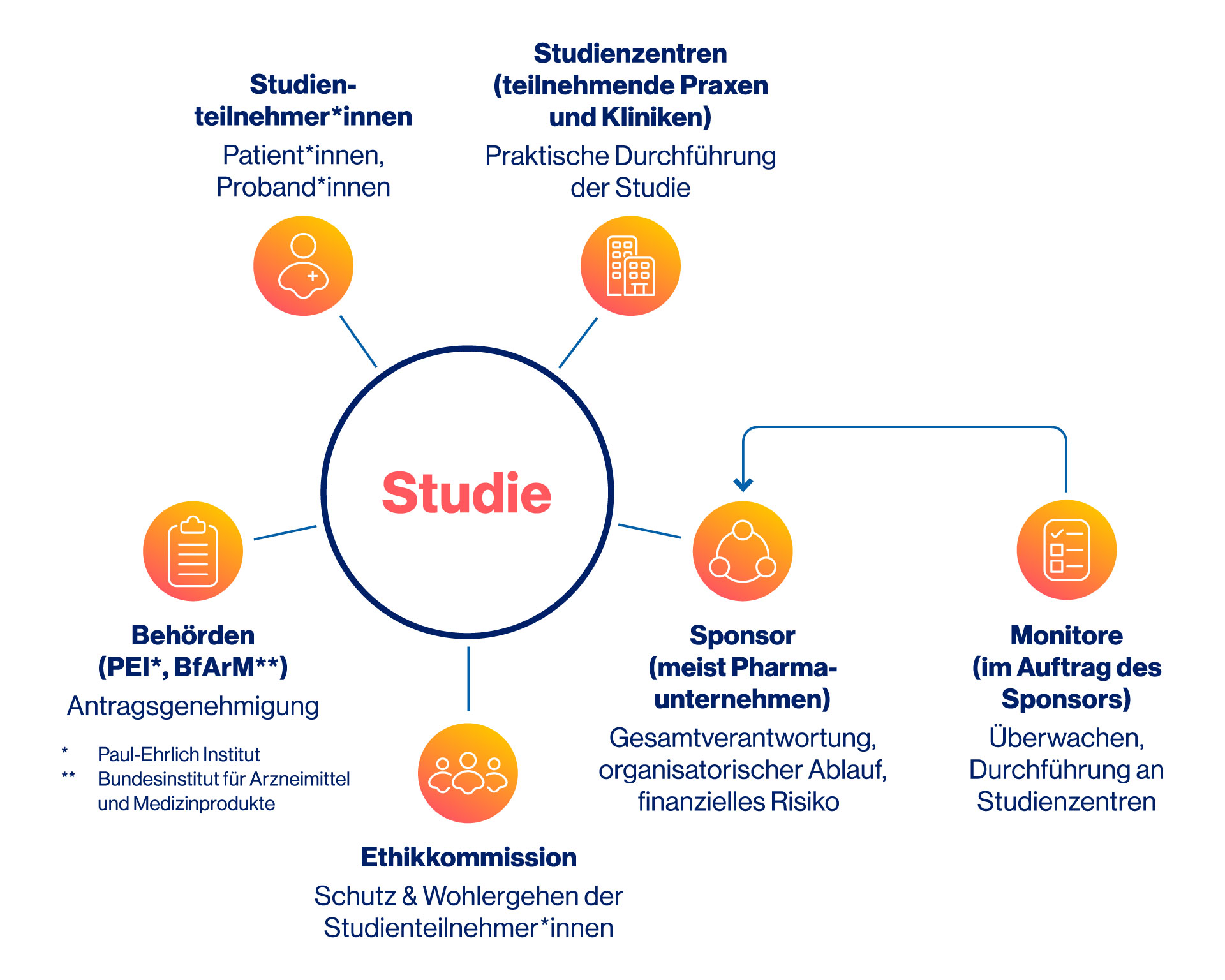
Wer ist an einer klinischen Studien beteiligt?
Bei einer klinischen Studie arbeiten viele verschiedene Personen und Institutionen zusammen, auch wenn Studienteilnehmende meist nur das Studienpersonal vor Ort erleben. Im Hintergrund sorgen zahlreiche Beteiligte dafür, dass die Studie sicher, ethisch korrekt und wissenschaftlich hochwertig durchgeführt wird. Die einzelnen Beteiligten haben unterschiedliche Aufgaben mit streng getrennten Verantwortungsbereichen:

- Auftraggeber (Sponsor): Der Sponsor, meist ein pharmazeutisches Unternehmen, finanziert die Studie und trägt die Gesamtverantwortung, sowohl für die Erstellung des Prüfplans und den organisatorischen Ablauf, als auch für Gewährleistung der Sicherheit der Teilnehmenden. Der Sponsor darf dabei keinen Einfluss auf die Ergebnisse nehmen.
- Studienzentren: In Studienzentren, zum Beispiel einer Klinik oder Arztpraxis, finden die Untersuchungen für eine klinische Studie statt. Studienärzt*innen und Studienpersonal erheben die Daten gemäß Prüfplan und betreuen die Teilnehmenden medizinisch. Die Studienzentren arbeiten unabhängig, auch wenn sie vom Sponsor beauftragt sind.
- Monitor*innen: werden vom Sponsor entsendet, um regelmäßig zu überprüfen, ob die Studie korrekt durchgeführt wird. Dabei achten sie besonders auf die Einhaltung der internationalen Standards der „Good Clinical Practice“ (GCP), sowie auf die wissenschaftliche Qualität und Nachvollziehbarkeit der erhobenen Daten.
- Behörden: In Deutschland sind das zum Beispiel das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) oder das Paul-Ehrlich-Institut (PEI). Sie prüfen die Studie auf medizinische, wissenschaftliche und rechtliche Aspekte. Nur wenn die Genehmigung der zuständigen Behörde vorliegt, wird die Studie zur weiteren Prüfung an die Ethikkommission übergeben.
- Ethikkommissionen: Diese unabhängigen Gremien bestehen aus medizinischen, juristischen und ethischen Expert*innen. Sie bewerten, ob die Studie ethisch vertretbar ist und das Wohl und die Sicherheit der Teilnehmenden gewährleistet werden kann. Ohne ein positives Votum der Ethikkommission darf keine Studie starten.