- Studienteilnahme als alternative Behandlungsoption
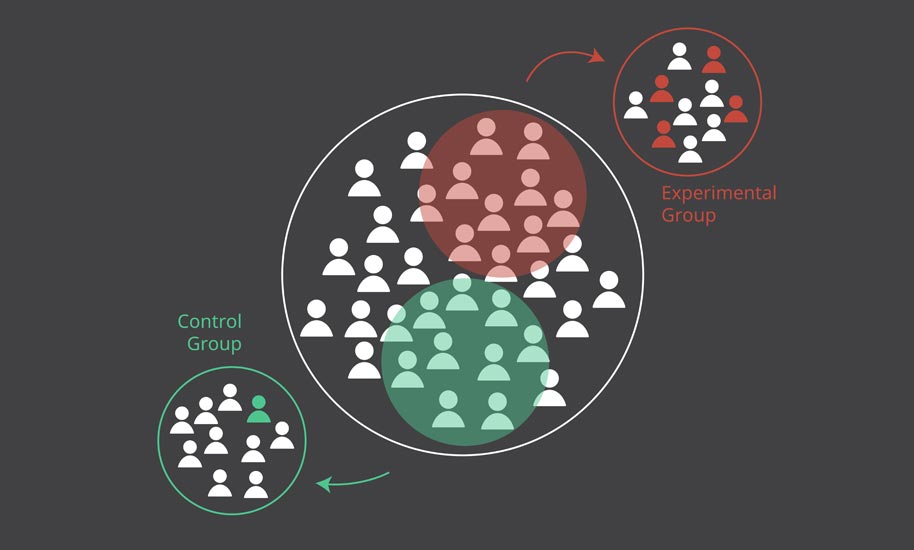
Insbesondere, wenn die bisherigen Behandlungen nicht angeschlagen haben, das verschriebene Medikament nicht richtig wirkt, oder es für eine Erkrankung noch gar keine Therapie gibt, suchen Patient*innen nach alternativen Behandlungen. Eine solche Alternative kann eine Studienteilnahme sein. Gerade Menschen, die an seltenen Erkrankungen oder an Krebs leiden, sind oft auf die Entwicklung neuer Medikamente oder neuer Krebstherapien angewiesen.
Für Patient*innen, die an einer lebensbedrohlichen oder schnell fortschreitenden Erkrankung leiden und bei denen alle bisherigen Therapien fehlgeschlagen sind, können Studien die Möglichkeit bieten, noch in der Forschungsphase Zugang zu neuartigen Medikamenten zu erhalten.
- Intensive medizinische Betreuung
Bei klinischen Studien stehen die Sicherheit und das Wohlergehen der Studienteilnehmenden immer an erster Stelle. Rechtliche Vorgaben und international vereinbarte Standards regeln daher genau, wie klinische Studien durchzuführen sind. Studienteilnehmende werden daher vor der Teilnahme über den gesamten Studienverlauf sehr genau aufgeklärt und während der Teilnahme engmaschig medizinisch betreut und untersucht. Für die Teilnehmenden bedeutet das normalerweise, dass sie mehr Arzttermine haben als zuvor im Rahmen der normalen Standardbehandlung.
Die Studienärzt*innen müssen sich aufgrund der Vorgaben für klinische Studien eng miteinander austauschen, teilweise auch fachübergreifend, je nachdem wie die Studie aufgebaut ist. Diese enge Vernetzung kann auch den Studienteilnehmenden zugutekommen.