Wie wirken neue Medikamente beim Menschen? Klinische Studien geben Antworten
Bevor ein neues Medikament auf den Markt kommt, muss es umfangreiche Prüfungen durchlaufen. Erst wenn alle vorklinischen Tests erfolgreiche abgeschlossen sind, darf der Wirkstoff in klinischen Studien am Menschen untersucht werden. Diese Studien können in Kliniken stattfinden, aber auch Arztpraxen können als sogenannte Studienzentren teilnehmen.
Die klinische Untersuchung eines neuen Wirkstoffs ist in mehrere Phasen unterteilt.
Entwicklungsphasen im Überblick
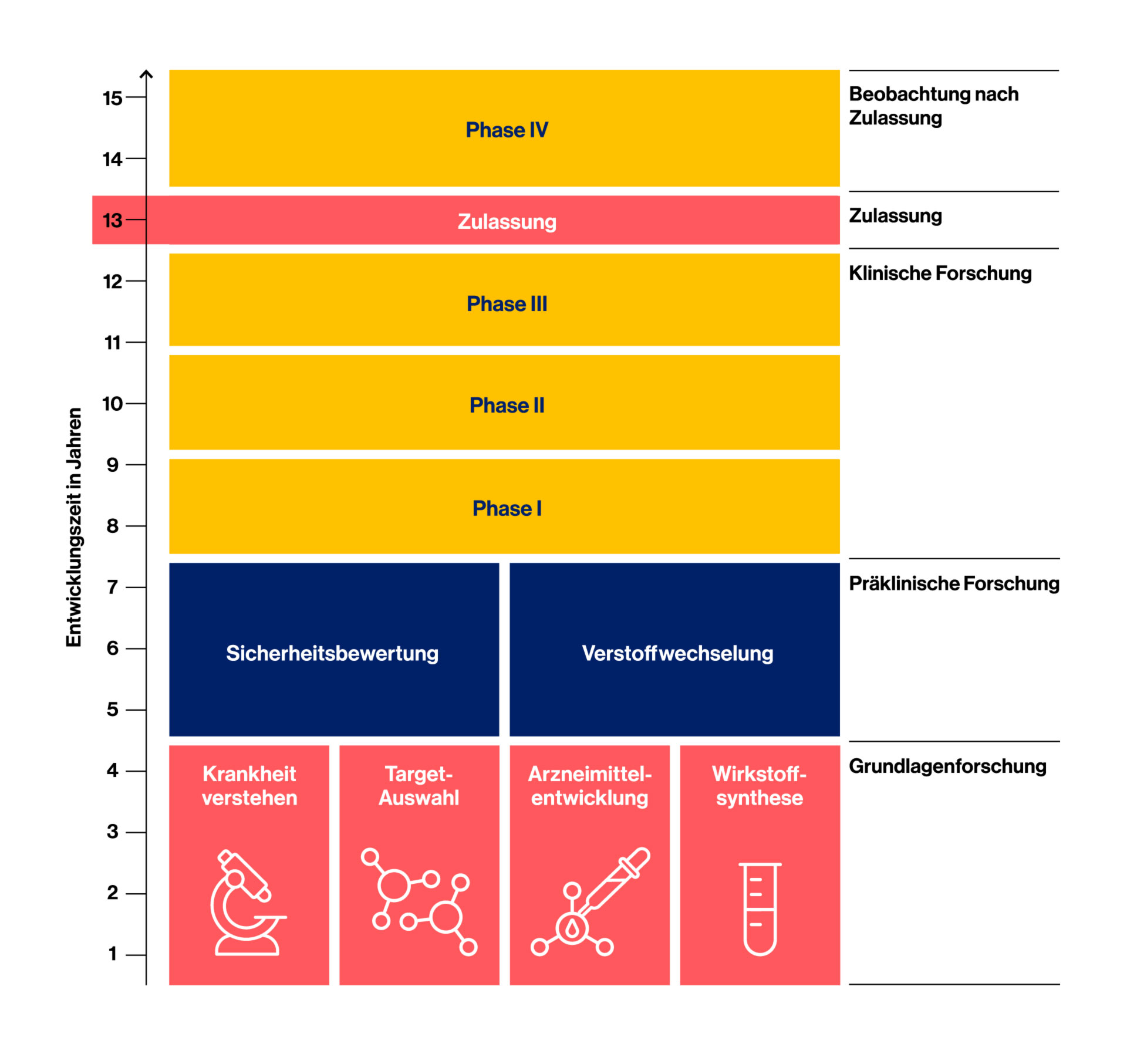
Phase I – Sicherheit bei gesunden Freiwilligen
In dieser ersten Phase wird das Medikament an gesunden Menschen getestet. Ziel ist es zu verstehen, wie der Wirkstoff im Körper verteilt und abgebaut wird, wie gut er vertragen wird und welche Nebenwirkungen auftreten können.
Phase II – Erste Erkenntnisse zur Wirksamkeit
Wenn in der Phase I genug Daten erhoben wurden, die die weitere Untersuchung des Medikaments befürworten, wird das Medikament im zweiten Schritt an erkrankten Menschen untersucht. Dabei wird untersucht, ob das Medikament die gewünschte Wirkung zeigt, welche Dosis optimal ist und wie gut es vertragen wird. Phase-II-Studien werden mit einer kleinen Anzahl von Patient*innen – meist 100 bis 500 – aus verschiedenen Ländern, durchgeführt.

Phase III – Bestätigung in großer Patient*innengruppe
An Phase-III-Studien nehmen oft mehrere Tausend Patient*innen weltweit teil. Ziel ist es, die Wirksamkeit und Sicherheit in einer breiten Bevölkerung zu bestätigen. In dieser Phase möchte man vor allem mehr über das Nebenwirkungsprofil des Medikaments erfahren, ob es zum Beispiel Reaktionen gibt, die nur bei bestimmten Bevölkerungsgruppen auftreten oder wie häufig bestimmte Reaktionen während einer Behandlung auftreten.
Studien der Phasen-II- und -III sind oft vergleichend aufgebaut. Bei einer Vergleichsstudie teilt man die Patient*innen in verschiedene Gruppen ein, welche unterschiedlich behandelt werden. Eine Gruppe erhält das neue Medikament (Prüfmedikament), während die andere Gruppe mit einem bereits zugelassenen Medikament (Standardtherapie) oder einem Placebo (Scheinmedikament) behandelt wird.
Bei einer anderen Studienvariante erhalten die Teilnehmenden eine Kombinationstherapie. Eine Gruppe erhält eine Kombination aus Basistherapie (z.B. die reguläre, zugelassene Behandlung für die jeweilige Erkrankung) und Prüfmedikament, während die andere Gruppe eine Kombination aus Basistherapie und einem Scheinmedikament (Placebo) erhält. Das Placebo sieht genauso aus wie das Prüfmedikament, enthält jedoch keinen Wirkstoff. Durch die Kombinationstherapie wird sichergestellt, dass alle Teilnehmenden einer Studie eine Behandlung für ihre Erkrankung erhalten, auch dann, wenn sie in der Placebogruppe behandelt werden.
Zulassung – Der Weg in die Versorgung
Nach erfolgreicher Phase III beantragt der Hersteller die Zulassung bei den zuständigen Behörden. Dieses Verfahren ist sehr aufwendig, die Ergebnisse aller Untersuchungen müssen vorgelegt und umfassend geprüft werden, bevor eine Entscheidung über die Zulassung gefällt wird.
Die wichtigsten Voraussetzungen zur Zulassung eines Medikaments sind eine angemessene Qualität bei der Herstellung, die Wirksamkeit bei der Behandlung der untersuchten Erkankung und die Sicherheit des Medikaments.
Entscheidend ist dabei das sogenannte Nutzen-Risiko-Verhältnis. Der Nutzen muss die potentiellen Risiken deutlich überwiegen. Das bedeutet, dass die gewünschte Wirkung des Medikaments mit möglichst wenigen und möglichst harmlosen Nebenwirkungen einhergehen muss.
Auch nach der Zulassung wird dieses Verhältnis regelmäßig überprüft. Neue Erkenntnisse, wie zum Beispiel bisher unbekannte Nebenwirkungen, können zu Einschränkungen oder sogar zum Rückruf führen. Im schlimmsten Fall muss es also vom Markt genommen werden.
Ein zentrales Dokument des Zulassungsverfahrens ist die Gebrauchsinformation (Beipackzettel), die alle wichtigen Informationen für Patient*innen über die Anwendung, Gegenanzeigen, die korrekte Dosierung, Wechselwirkungen und mögliche Nebenwirkungen des Medikaments enthält. Die Gebrauchsinformation darf nur mit Genehmigung der Behörde geändert werden.

Warum die Forschung nach der Zulassung weitergeht
Nur ein Bruchteil aller Wirkstoffe schafft es bis zur Marktzulassung. Statistisch gesehen ist es weniger als einer von 10.000. Hat ein Medikament diesen langen und aufwändigen Entwicklungsrozess erfolgreich durchlaufen und wurde von den zuständigen Behörden zugelassen, stellt sich oft die Frage: warum wird danach weiter geforscht?

Phase IV – Erkenntnisse unter Alltagsbedingungen
Phase-IV-Studien werden nach der Zulassung des Medikaments durchgeführt. Denn auch wenn Tausende von Patient*innen an den Studien vor Zulassung (Phase I- III) teilgenommen haben, gibt es bei der Markteinführung trotzdem nur begrenzte Erkenntnisse über das neue Medikament. Das hat verschiedene Gründe:
- Die Auswahl von Studienteilnehmer*innen von Phase I – III Studien erfolgt nach strengen Kriterien. Teilnehmende müssen möglichst gleiche Voraussetzungen aufweisen, damit die Ergebnisse der Untersuchungen vergleichbar sind. Das bedeutet, dass bestimmte Gruppen, wie zum Beispiel ältere Menschen oder Personen mit Vorerkrankungen, ausgeschlossen werden.
- Die Einnahmebedingungen im Alltag unterscheiden sich oft von der kontrollierten Studiensituation. Auch unterschiedliche Ernährungsgewohnheiten können einen großen Einfluss auf die Wirkung des Medikaments haben.
- Begleiterkrankungen und andere Faktoren wie zum Beispiel Langzeitwirkungen können in den Phasen I – III von klinischen Studien nicht oder nur unzureichend erfasst werden und werden erst über Jahre sichtbar.
Phase-IV-Studien dienen daher einerseits dazu, bei einer großen Zahl unterschiedlicher Patient*innen Informationen zum Medikament zu sammeln. Anderseits können weitere Vergleiche mit bereits länger zugelassenen Medikamenten oder Therapien angestellt werden oder Kombinationstherapien von neuen Medikamenten mit herkömmlichen Medikamenten untersucht werden.
Nicht-interventionelle Studien (NIS) – Beobachtung im echten Leben
Unter nicht-interventionellen Studien (NIS) oder auf englisch auch “non-interventional studies” genannt, versteht man alle Formen von Arzneimittelstudien, die sich mit der Wirksamkeit eines bereits auf dem Markt befindlichen Medikaments beschäftigen. Dabei wird der Einsatz bereits zugelassener Medikament im Praxisalltag beobachtet. Das bedeutet es wird nicht aktiv in die Behandlung eingegriffen. Konkret wird im Rahmen einer NIS ein bereits zugelassenes Medikament also nicht nach einem festgelegten Studienplan verabreicht, sondern es wird lediglich beobachtet und dokumentiert, wie die Ärztin / der Arzt das Medikament in seiner täglichen Praxis einsetzt. Dazu gehört die Beobachtung der Patientin / des Patienten in Bezug auf unterschiedliche Faktoren, die in klinischen Studien kaum berücksichtigt werden, wie zum Beispiel Wechselwirkungen mit anderen Arzneimitteln und die Regelmäßigkeit der Medikamenteneinnahme. Ziel ist es, reale Erfahrungen aus der Versorgung zu sammeln und weiterhin wertvolle Erkenntnisse über die Wirksamkeit und Verträglichkeit von bereits zugelassenen Medikamenten zu gewinnen.